Ipilimumab si lega al recettore inibitore CTLA-4 riattivando la risposta immune contro le cellule neoplastiche. Questo trial ha randomizzato 951 pazienti, con melanoma in stadio III resecato, a ricevere ipilimumab (10 mg/kg q 21 per 3 dosi, poi q 3 mesi per 3 anni) vs placebo. Endpoint primario RFS.
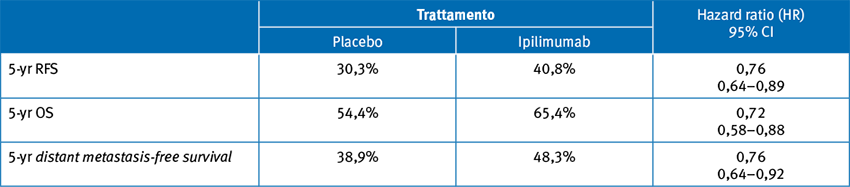
Ipilimumab impatta significativamente su RFS e OS quando viene utilizzato con intento adiuvante nel melanoma resecato in stadio III e la consistenza interna del trial è rinforzata dal risultato ‘‘positivo’’ in tutti gli endpoint.
È importante far emergere come il braccio di controllo di questo importantissimo trial registrativo fosse placebo e non interferone: questo dimostra come, prima dell’avvento di ipilimumab, l’utilizzo di interferone in adiuvante non fosse ritenuto standard.
La tossicità di ipilimumab è stata caratterizzata da 16% di diarrea/colite, 8% di endocrinopatie e 11% di tossicità epatica G3-4. Ipilimumab ha causato la morte di 5 pazienti trattati (1,1%) ma va anche ricordato che la dose utilizzata (10 mg/kg) è tripla rispetto alla dose utilizzata nel setting palliativo (3 mg/kg).